リアルタイムPCR
リアルタイムPCR-SYBR Green法
SYBR green法の利点は、プローブの設計や用意を必要としないため、プローブアッセーと比べ安価であるとされています。しかしながら、欠点として、プライマー二量体のような非特異的な2本鎖DNAも検出してしまうこと、マルチプレックス解析が行えないことが挙げられます。 一般的には、プライマー二量体が非特異的に検出されていないかを確認するために融解曲線分析を行います。
融解曲線分析
融解曲線分析ではPCR後に、反応液の温度を徐々に上昇させ、SYBR Green のシグナルを検出します。温度が低い時は、2本鎖を形成しているので、蛍光シグナルが検出されますが、温度が徐々に上昇し、融解温度に達すると、この2本鎖が解離して1本鎖にり、蛍光シグナルが急激に低下します。通常、プライマー二量体がない場合、反応液内の2本鎖形成をしているのは1つの増幅産物であるため、融解曲線のピークは1つとなりますが、反応液内で、目的産物以外が増幅されたり、プライマー二量体形成が認められる場合は、ピークが2つ以上認めらます。このような場合には、増幅産物を電気泳動しバンドが1つであるか確認する必要が出てきます。
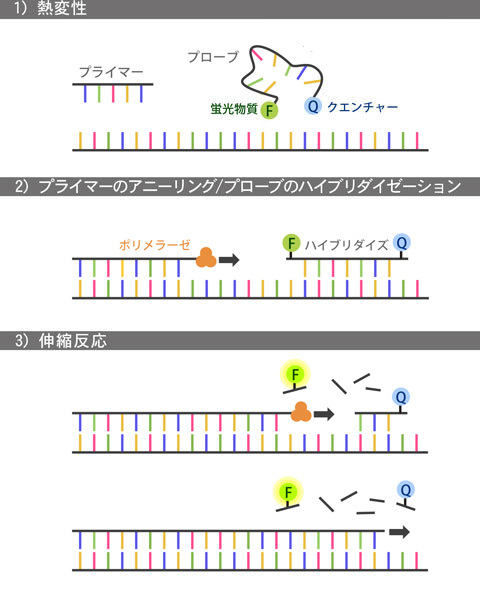
リアルタイムPCR-TaqManプローブ法
リアルタイムPCRでの定量方法
リアルタイムPCRでの定量は、コピー数を算出する絶対定量法と相対値で発現を調べる相対定量法に分けられます。 絶対定量法とは、あらかじめ濃度の分かっている目的産物のDNAを段階希釈し、希釈系列を用いてリアルタイムPCRを行い検量線を得、濃度不明のサンプルのCt値を検量線にあてはめコピー数を計算します。一方で、相対定量法は、主にmRNAの発現の定量に最も一般的に用いられている方法で、目的遺伝子とリファレンス遺伝子を同時に解析しリファレンス遺伝子に比べ、目的遺伝子がどれだけ発現しているかを相対的に比較したものです。
定量RT-PCR
リアルタイムPCR(real time PCR)と逆転写ポリメラーゼ連鎖反応(reverse transcription PCR; RT-PCR)と組み合わせることで、mRNAの定量を行うことができ、特定の時間、細胞、組織における遺伝子の発現をみることができます。この組み合わせによる技法を"定量RT-PCR" (quantitative reverse transcription PCR) 法と呼びます。 リアルタイムの装置の中で逆転写反応を行うOne-step RT-qPCRと、あらかじめ作成しておいたcDNAを用いてRT-qPCRを行うTwo-step RT-qPCRに大きく分けられる。前者はDNAの増幅で用いるものと同じプライマーを用いて逆転写反応を行う方法であり、感度、特異度が高く微量RNAの検出に優れています。また、チューブを移し替える回数が減るので、簡便でコンタミネーションの危険も少なくなります。


リアルタイムPCR(Real-time Polymerase Chain Reaction)とは定量PCR(Q-PCR)のひとつで、ポリメラーゼ連鎖反応による増幅をリアルタイムに測定することで、その増幅率に基づいて鋳型DNAの定量を行なう方法です。
この定量は蛍光色素を用いて行うのが一般的で、インターカレーション法、ハイブリダイゼーション法、LUX法等があります。インターカレーション法では、2本鎖DNAに特異的に挿入(インターカレート)して蛍光を発する色素(SYBR green I)を用いますが、一方、ハイブリダイゼーション法ではTaqManプローブを用いる方法が最も一般的、DNA配列に特異的なオリゴヌクレオチドに蛍光色素を修飾したプローブ(TaqManプローブ)を用います。